製品情報

安全性及び性能
モチジェル🄬は海藻由来のアルギン酸を原料としております

天然の海藻から抽出されるアルギン酸を原料としています。天然由来のアルギン酸は、エンドトキシン※を多く含有し、そのままの状態ではインプラントの原料として使用出来ませんでした。そこで弊社では体内に埋植可能な医療機器とするため、低エンドトキシン化したアルギン酸を原料として生物学的安全性試験で評価された医療機器を開発しました。
※エンドトキシンは、グラム陰性桿菌の細胞壁の構成成分であるリポ多糖類であり、グラム陰性桿菌の死滅や破壊にともない遊離される発熱物質の一つです。エンドトキシンが混入した場合、発熱などさまざまな生体反応を引き起こすことが知られています。
特定生物由来製品に非該当
アルギン酸は海藻由来のバイオマテリアルであるため、人獣共通感染症※の蓋然性の低い原料です。
※人獣共通感染症とは、同一の病原体により、ヒトとヒト以外の脊椎動物の双方が罹患する感染症です。病原体には、異常プリオンタンパク、ウイルス、細菌、寄生虫、真菌があります。病原体によってもたらされる症状は様々で軽症のものから重症のものまでありますが、中には狂犬病のように致死性の高いものもあります。
モチジェル🄬の治験における安全性と性能
本邦で行われた2 回(①パイロット試験、②検証的治験)の治験において、モチジェル🄬に起因する有害事象、および不具合は認められませんでした。
①パイロット試験1)2)3)
|
試験 ID |
jRCT1080223051 |
|---|---|
|
試験名 |
dMD-001 パイロット試験 |
|
目的 |
膝又は肘の関節軟骨損傷患者(外傷性軟骨欠損症あるいは離断性骨軟骨炎)における、dMD-001 の性能及び安全性を探索的に検討する。 |
|
対象 |
膝又は肘の関節軟骨損傷患者(外傷性軟骨欠損症あるいは離断性骨軟骨炎) |
|
試験の種類 |
非対照試験 |
|
手術例数 |
膝:12 例、肘:5 例 |
|
主要評価項目 |
主要エンドポイント
|
|
性能 |
|
|
安全性 |
以下にパイロット試験において認められた全ての有害事象を示す。 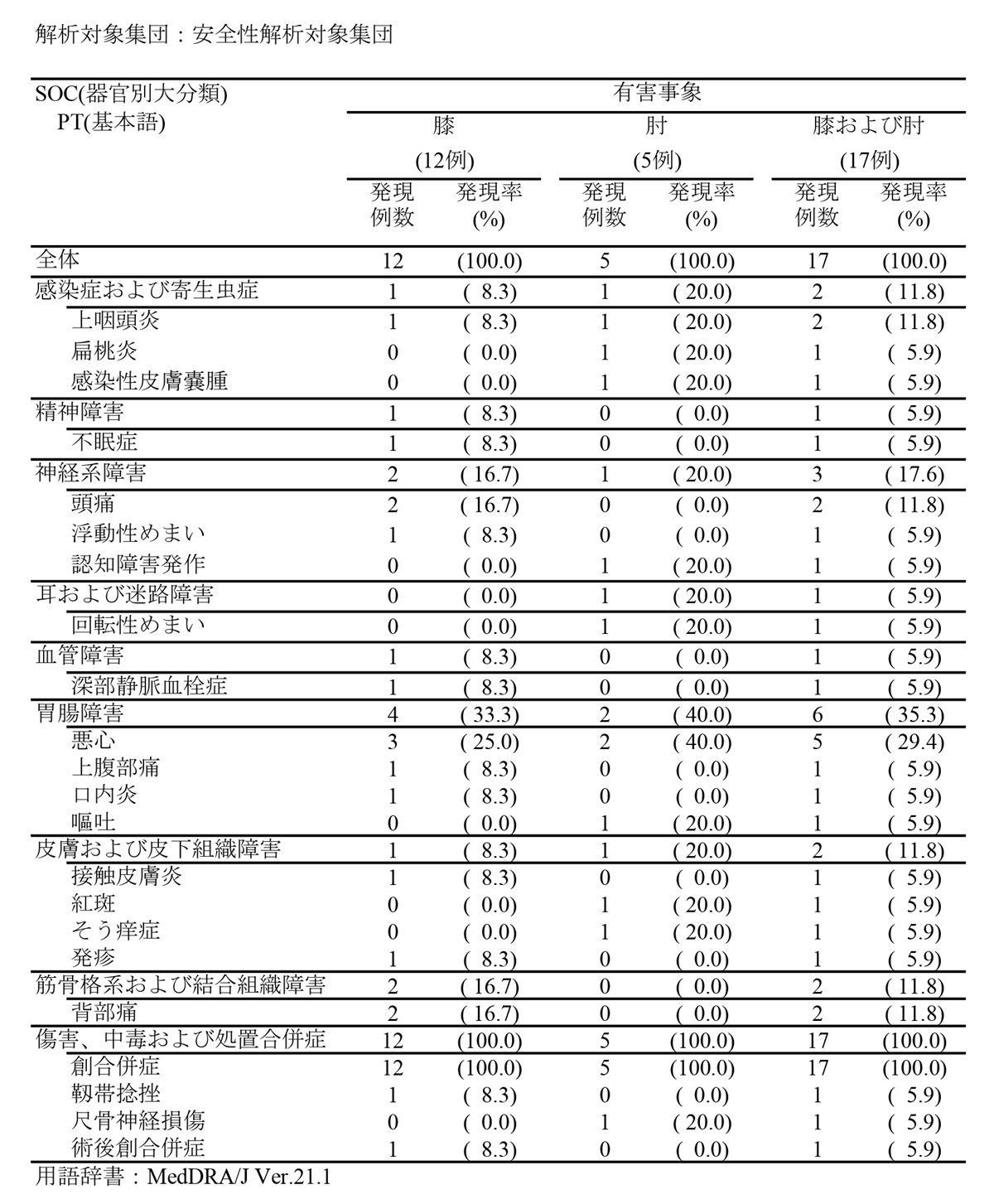
|
②検証的治験4)
|
試験 ID |
jRCT1080224716 |
|---|---|
|
試験名 |
dMD-001 検証的治験 |
|
目的 |
膝又は肘の関節軟骨損傷患者(外傷性軟骨欠損症あるいは離断性骨軟骨炎)においてdMD-001 がモザイクプラスティと同程度の性能を有することを検証するとともに、dMD-001 の安全性について検討する。 |
|
対象 |
膝又は肘の関節軟骨損傷患者(外傷性軟骨欠損症あるいは離断性骨軟骨炎) |
|
試験の種類 |
多施設共同非盲検単腕既存対照(モザイクプラスティ)比較試験 |
|
手術例数 |
膝:22 例、肘:8 例 |
|
主要評価項目 |
|
|
性能 |
|
|
安全性 |
以下に検証的治験において認められた全ての有害事象を示す。 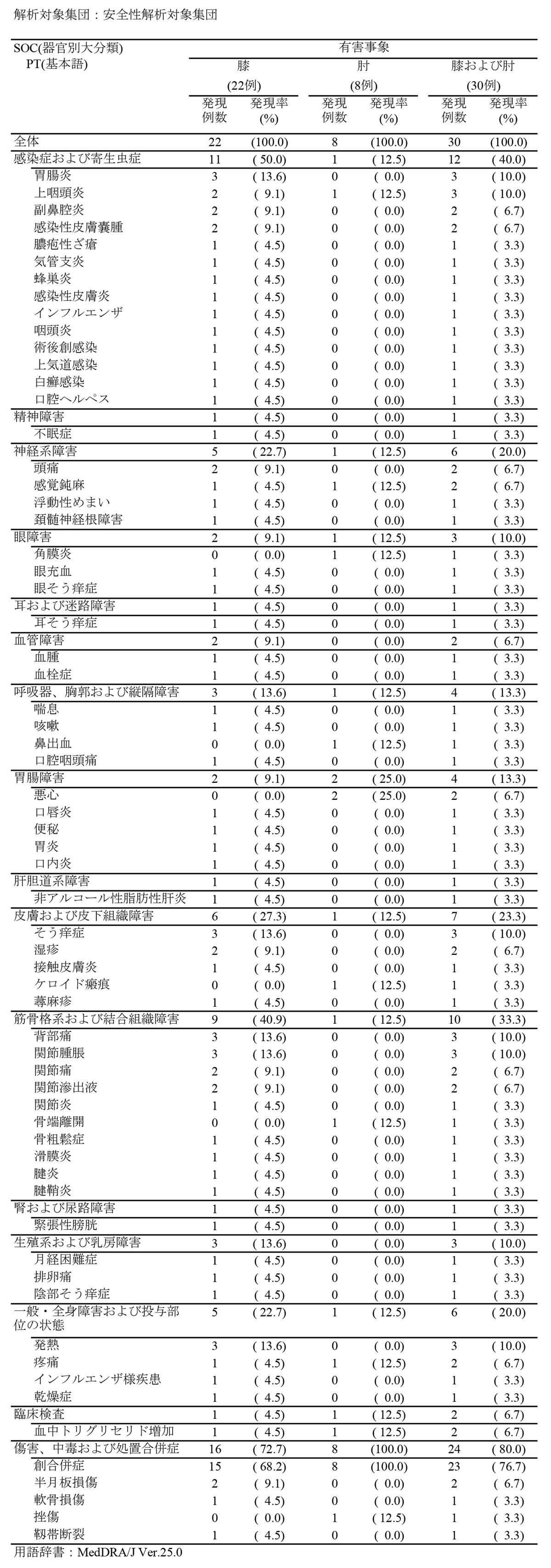
|
1) Momma D, Onodera T, et al.: The Orthopaedic Journal of Sports Medicine 2021; 9(3). DOI
:10.1177/2325967121989676
2) Onodera T, et al.: THE BONE & JOINT JOURNAL 2023;105-B (8):880-887. DOI:
10.1302/0301-620X.105B8.BJJ-2022-1071.R2
3) 持田製薬社内資料:パイロット試験 承認時評価資料
4) 持田製薬社内資料:検証的治験 承認時評価資料
